【細胞科技專欄】NK細胞筑牢對抗HPV的“第一道防線”
供稿機構:漢氏聯合高等研究院南開大學博士后工作站
作者:楊思俊博士
前言
在女性常見的惡性腫瘤中,宮頸癌的發病率僅次于乳腺癌,大多數宮頸癌是由HPV感染所致。全球每年新發病例近60萬,死亡約30萬。中國每年新增病例約13.5萬,其中8萬人因此死亡。考慮到HPV感染的普遍性和致癌性,對HPV感染的治療值得高度重視。
HPV(人乳頭瘤病毒)是一種來自乳頭瘤病毒科的DNA 病毒。許多 HPV 感染不會引起任何癥狀,90% 會在兩年內自行消退。然而,在某些情況下,HPV 感染持續存在并導致疣或癌前病變。根據受影響的部位,這些病變會增加宮頸癌、外陰癌、陰道癌、陰莖癌、肛門癌、口咽癌、扁桃體癌的風險。
HPV有200多種基因型,分為高危型和低危型病毒,HPV16和HPV18兩種毒株占宮頸癌病例的 70%。HPV16占據幾乎90%的HPV陽性口咽癌。另外,HPV6和HPV11是生殖器疣和喉乳頭狀瘤病的常見原因。
在生命的某個階段,幾乎每個人都會感染HPV,3%-5%的感染人群會由感染轉變為腫瘤。人類歷史上可以預防腫瘤的疫苗只有兩個,HBV(乙肝病毒)疫苗和HPV疫苗。預防接種HPV疫苗,是預防青春期免疫婦女宮頸癌的有效方法。
那么,還有很多未接種疫苗的感染者,我們該如何治療?
從文獻調研的情況看,我們發現NK細胞是先天免疫系統的重要屏障和關鍵組成部分,這些細胞具有通過兩種機制識別和殺死HPV病毒感染和轉化的細胞:顆粒依賴性細胞毒性以及靶細胞的凋亡途徑。在已經感染HPV病毒的個體中,NK細胞在天然免疫中能否發揮清除病毒的作用是我們關注的焦點,因此,本文綜述了NK細胞與HPV相關研究進展,供參考。
以NK為核心的先天免疫的抗病毒模式圖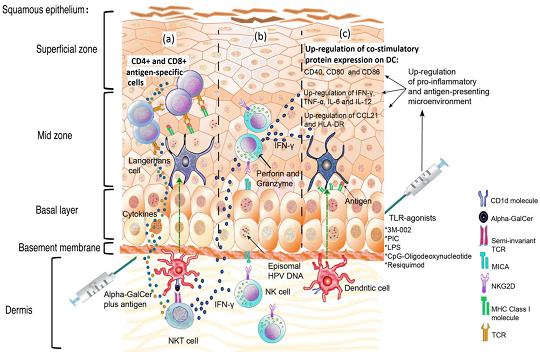
圖注:HPV 感染期間輔助刺激后先天免疫反應作用的示意圖。
(a)使用 α-GalCer 和 HPV 抗原刺激自然殺傷 T (NKT) 細胞,促進 CD4+ 和 CD8+ T 細胞抗原特異性反應以及高水平炎癥細胞因子(如 IFN-γ)的快速釋放。
(b)NK細胞可以通過IFN-γ通過諸如α-GalCer和Toll樣受體(TLR)激動劑的佐劑間接激活后殺死HPV感染的細胞。
(c)通過 TLR 激動劑誘導促炎反應從 HPV 誘導的微環境中拯救角質形成細胞以促進抗原呈遞。
HPV感染影響NK細胞的活性
NK 細胞活性主要通過抑制受體和激活受體之間的平衡受到嚴格調節。然而,這些受體的失調在HPV 感染中很常見。在宮頸癌患者的 NK 細胞中發現 NKp30 和 NKp46 受體水平較低,這與 NK 細胞的低細胞毒活性有關[1, 2]。NK 細胞中另一個與細胞毒性相關的重要受體是 NKG2D。該受體通過與主要組織相容性復合體 I 類相關鏈 A (MICA) 蛋白的相互作用參與NK細胞介導細胞裂解作用。NKG2D 和 MICA 在存在 HPV 感染的情況下都受到調節[3, 4]。此外,血清中游離 MICA 的水平與宮頸癌進展相關,這表明導致 HPV 持續存在或腫瘤進展的一個重要因素可能是血清中可溶性 MICA 的存在。在 NK 細胞系 (NKL) 中,發現當 NKL 與宮頸癌細胞系 HeLa、SiHa 或 C33A 共培養時,NKG2D 受體被下調,但非致瘤性永生化角質形成細胞 HaCaT 不存在。在與 HPV 陽性癌細胞系(HeLa、SiHa)接觸后,NK細胞系中 NKG2D 的這種下調與NK細胞毒性活性降低有關,但與 HPV 陰性細胞系 C33 或非致瘤性 HaCat 細胞接觸后則不行。
綜合以上幾篇文獻報道,我們發現無論是在HPV感染宮頸癌患者或者細胞系實驗中,我們均發現NK細胞的活性均不同程度的被抑制,而這個抑制作用主要通過下調NK細胞的表面受體(NKp30 、NKp46、NKG2D)活性來實現。因此,我們認為,HPV持續的感染后抑制NK細胞的抗腫瘤效應是腫瘤發生的重要因素之一。
對HPV感染細胞的殺傷作用
如果HPV的感染會抑制NK細胞的活性,那么解除NK的抑制作用,是否會激活NK細胞的活性呢?
有限的文獻報道中,我們發現,某些藥物能夠降低 MICA 血漿水平,允許 NK 細胞攻擊表達 MICA 的細胞。例如,肼苯噠嗪和丙戊酸鹽的給藥可以增加CaSki宮頸癌細胞系中MICA和MICB配體的表達并減少它們向上清液的脫落,從而允許NK攻擊;而不含肼苯噠嗪和丙戊酸鹽的細胞不易受到 NK 攻擊[5]。HPV還可以通過改變免疫抑制酶吲哚胺-2,3-雙加氧酶(IDO)來逃避NK細胞的細胞毒機制,IDO的表達與腫瘤細胞逃避免疫監視有關。IDO 的缺失與 NK 細胞活性增加有關。例如,用靶向 IDO 基因 (shIDO) 的短發夾 RNA (shRNA) 質粒轉染的 CaSki 細胞比對照細胞 (CaSki/Mock)在體外更容易受到 NK 細胞攻擊。此外,體內在 BALB/c 裸鼠中進行的檢測顯示,與對照皮下腫瘤相比,CaSki/shIDO 形成的腫瘤的基質中 NK 細胞的積累更多。并且,低水平的 IDO 增加了宮頸癌細胞對 NK 細胞的易感性,表明 IDO 靶向 shRNA 干擾序列可以解除NK的抑制,有助于宮頸癌的靶向治療[6]。
盡管 HPV 為逃逸 NK 細胞殺傷而采用的一些機制是已知的,但 NK 細胞在病毒感染自然史中的作用還在研究,例如當前的新冠病毒。此外,有研究探討佐劑或藥物在感染早期可能增加 NK 細胞數量及其對 HPV 感染細胞的細胞毒活性或在后期對 HPV 陽性腫瘤細胞的作用。如模式圖中所示,一些佐劑可能通過IFN-γ間接激活NK細胞。
另外,最有意思的報道是,目前可用的 Gardasil HPV 疫苗可以增加免疫后 NK 細胞的數量,這與 NK 細胞中 NKG2D、NKp30、Nkp46 和 ILT2 受體的表達增加有關,表明除了中和抗體的增加外,還有NK細胞也參與了抗病毒過程,提高了疫苗有效性[7]。這提示我們,在針對HPV感染的治療方法中,除了疫苗接種產生的抗體外,NK細胞的作用不可忽視。從機制的角度分析,抗體僅僅是中和病毒,然而針對已經感染HPV病毒的細胞的清除仍然是需要NK細胞介導的毒性作用來完成。因此我們強烈建議,在針對HPV感染的治療中,要分情況實施方案,未感染過HPV的患者,疫苗的接種可作為預防措施,同時輔助NK細胞的輸注提高疫苗的有效率,而通過體檢篩查發現已經感染HPV的患者,NK的輸注可以成為主要的治療方案。
臨床案例
BVAC-C是一種以人乳頭瘤病毒(HPV)16/18E6/E7基因轉染的B細胞和單核細胞(NK細胞其中之一)為基礎的免疫治療性疫苗,負載有α-半乳糖基神經酰胺。這項I期研究試圖確定BVAC-C在鉑類耐藥復發宮頸癌患者中的耐受性和免疫原性。研究對象為HPV16陽性或18陽性復發性或持續性宮頸癌患者,這些患者之前至少接受過一次鉑類聯合化療。BVAC-C每4周靜脈注射3次,劑量遞增按1×10^7、4×10^7或1×10^8個細胞/劑量的3人隊列設計進行。11名患者入選,其中6名(55%)患者在入選前接受了兩次或兩次以上的鉑類化療。觀察21個周期的治療相關不良事件(TRAE)。TRAE多為輕度發熱(n=6,55%)或肌痛(n=4,36%)。未發生劑量限制毒性。5例(56%)患者病情穩定4.2~11個月,總體療效最佳。所有患者的中位無進展生存期為6.8個月(95%CI,3.2~無限個月),6個月和12個月的總生存率分別為89%(95%CI,71~100%)和65%(95%CI,39~100%)。
BVAC-C在所有患者接種疫苗后均能誘導自然殺傷T細胞(NKT細胞)、自然殺傷細胞(NK細胞)和HPV16/18E6/E7特異性T細胞的活化。BVAC-C耐受性良好,在HPV16陽性或18陽性復發宮頸癌患者中表現出持久的抗腫瘤活性和免疫應答。二期療效試驗目前正在進行中[8]。
總結
值得注意的是,超過一半的女性在首次性行為后不久就出現了宮頸HPV感染,但是,大約90%的這種感染在3年內就被清除了。對HPV的免疫力可能是消除病毒的重要因素。涉及巨噬細胞、自然殺傷細胞和自然殺傷T細胞的先天免疫反應可能在對抗HPV感染的第一道防線中發揮作用。在第二道防線中,通過針對HPV16E2和E6蛋白的細胞毒性T淋巴細胞(CTL)進行適應性免疫似乎可以消滅感染HPV16的細胞。由此可見,通過NK細胞之類的非特異性免疫細胞建立第一道防線非常重要,也是第二道防線的基礎。
然而,HPV可以逃避宿主的免疫反應。首先,HPV在病毒復制過程中不會殺死宿主細胞,因此既不呈現病毒抗原,也不會引起炎癥。HPV16E6和E7蛋白下調宿主細胞中1型干擾素(IFN)的表達。在抗原識別過程中,包括IFNs在內的炎性細胞因子缺乏共刺激信號可能會誘導免疫耐受,而不是適當的免疫反應。在這個過程中,NK細胞及一些非特異性免疫細胞是干擾素分泌的主要細胞。此外,HPV16E5蛋白可下調HLA-1類分子的表達,并有助于逃避毒性T細胞特性行免疫攻擊。這些免疫逃避機制可能最終支持HPV持續感染的建立,從而導致宮頸癌的誘發。
因此,從文獻報道和臨床案例分析來看,輸注NK細胞將有助于建立HPV感染第一道防線的建立,同時提高疫苗接種的有效率,也可以在特異性免疫中起到橋梁作用。


