【漢氏聯合細胞科技專欄】異體干細胞移植,干預宮頸癌出“奇招”
供稿機構:漢氏聯合高等研究院南開大學博士后工作站
作者:楊思俊博士
異基因造血干細胞移植
異基因造血干細胞移植(allogeneic hematopoietic stem cell transplantation, Allo-HSCT) 是一種治療血液系統等某些惡性腫瘤的有效手段
早期動物實驗研究顯示,經異基因造血干細胞移植治療的白血病小鼠伴有移植物抗宿主病 (graft versus host disease.GVHD) 者,但白血病復發減少,這種效應被稱為移植物抗白血病(graft versus leukemia.GVL)效應。
GVL效應是移植后異基因免疫細胞產生的一種特有的抗腫瘤免疫效應,是移植物抗腫瘤(graft versus tumor,GVT) 效應的一部分。
其主要原理是:在造血干細胞移植時通過接受大劑量化療、放療可最大限度地殺滅體內白血病細胞,并且受者在經受強烈免疫抑制后,供體骨髓中的造血干細胞在受者體內被激活,重建造血功能后同時實現了免疫重建,異體重建的免疫細胞不受腫瘤微環境的限制,實現了抗腫瘤作用,移植物抗腫瘤效應應該作為抗腫瘤免疫細胞療法重點關注的領域。
關注宮頸癌

2021年10月,《Clin Case Rep》雜志報道一則案例很好的驗證了移植物抗腫瘤效應,在該報道中,一名女性患者因為急性髓系白血病接受異體干細胞移植,卻發現宮頸鱗狀細胞癌 (SCC) 轉變為上皮內病變或惡性腫瘤陰性(negative for intraepithelial lesion or malignancy,NILM),案例詳細情況如下:
1、患者病歷簡述
一名32歲女性因陰道異常出血住院。病史顯示,患者在 14 歲時有性病感染史可能伴有HPV感染,在 26 歲時被診斷出患有急性髓系白血病。因此,住院之后,患者接受了異體干細胞移植,同時,患者宮頸細胞病理切片顯示為鱗狀細胞癌。
_
住院之后,患者接受了異體干細胞移植,同時,患者宮頸細胞病理切片顯示為鱗狀細胞癌。
_
隨后患者進行了宮頸錐切術,切除部位的病理診斷為宮頸上皮內瘤變(CIN)。宮頸上皮內瘤變是一組與宮頸浸潤癌密切相關的癌前病變的統稱,包括宮頸不典型增生和宮頸原位癌,通常由HPV感染、免疫缺陷、吸煙等因素誘發導致。
_
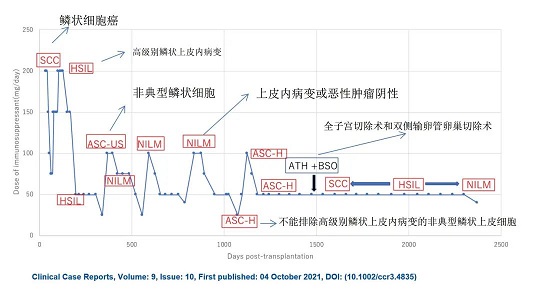
錐切后宮頸病理切片持續顯示宮頸鱗狀細胞癌(SCC) 或高級別鱗狀上皮內病變 (HSIL)。理想情況下,會進行再錐切術或子宮切除術。然而,患者無法進行這些手術,因為患者在異體干細胞移植后出現晚期骨髓衰竭導致的血細胞減少癥。因此,經常因為全血細胞減少癥進行輸血。
_
由于核磁共振上沒有宮頸腫瘤的證據,在進修婦科治療前,針對急性髓系白血病接受了第二次異體干細胞移植。然后患者出現了急性移植物抗宿主病,伴有高燒、皮疹和腹瀉。在急性移植物抗宿主病后出現慢性移植物抗宿主病,而免疫抑制劑的劑量也逐漸減少,并在第二次異體干細胞移植后 4 個月出院。
_
出院時候,也就是第二次異體干細胞移植4個月后,婦科病理檢查顯示,宮頸鱗狀細胞癌(SCC) 轉變為 HSIL,11個月后轉變為未確定意義的非典型鱗狀細胞,16 個月后轉變為上皮內病變或惡性腫瘤陰性(NILM)。
_
在第二次異體干細胞移植之后33個月再次變為高級別鱗狀上皮內病變 HSIL。由于宮頸細胞學異常持續存在,患者選擇在第二次異體干細胞移植后第4 年進行了腹部全子宮切除術和雙側輸卵管卵巢切除術,病理診斷為宮頸上皮內瘤變,3級/HSIL。手術切緣陰性。雖然術后陰道殘端細胞學顯示為 SCC,但在術后5個月改善至 HSIL。
_
錐切后宮頸病理切片持續顯示宮頸鱗狀細胞癌(SCC) 或高級別鱗狀上皮內病變 (HSIL)。理想情況下,會進行再錐切術或子宮切除術。然而,患者無法進行這些手術,因為患者在異體干細胞移植后出現晚期骨髓衰竭導致的血細胞減少癥。因此,經常因為全血細胞減少癥進行輸血。
_
第二次異體干細胞移植已經7年多了,雖然還在服用小劑量的免疫抑制劑,但白血病沒有復發。子宮切除也已經3年多了,高級別鱗狀上皮內病變 HSIL也轉為NILM,不用治療。
2、患者病程圖
3、類似案例報道
在查閱相關文獻中,也發現同種異體移植治療的腎癌、乳腺癌、結直腸癌、卵巢癌和胰腺癌患者中觀察到同種異體移植物抗腫瘤效應。
例如:最早在《blood》雜志上報道了一名患有炎性乳腺癌的 32 歲女性接受了來自與 HLA 相同的兄弟姐妹的骨髓移植 (BMT),在 27 天后在 CT 上顯示肝轉移完全緩解。遺憾的是,該患者在110天后因病情過于嚴重去世,但是尸檢證實,該患者沒有進一步發現轉移,脊柱也沒有發現骨轉移[2]。

另外,醫學著名期刊《The New England Journal of Medicine》也曾報道過類似的研究,19名有合適供體的難治性轉移性腎細胞癌患者接受了環磷酰胺和氟達拉濱的化療方案,然后輸注了來自 HLA 相同兄弟姐妹或不匹配的兄弟姐妹的外周血干細胞移植物,19名患者中有9名在移植后287至831天存活(中位隨訪時間為402天)。10名患者 (53%) 轉移性癥狀消退;3人有完全反應,7人有部分反應。完全緩解的患者在移植后27、25和16個月仍處于緩解狀態。轉移的消退被延遲,發生在移植后的中位時間為129天,并且經常發生在環孢素停用和完全供體-T 細胞嵌合體建立之后。這些結果與移植物抗腫瘤效應一致[3]。
4、相關討論
總的來說,干細胞移植通常不能直接對抗癌癥。相反,它們可以幫助您在使用非常高劑量的放射治療,化療或兩者治療后恢復身體產生干細胞的能力。
過往,在多發性骨髓瘤和某些類型的白血病中,干細胞移植可能直接對抗癌癥,部分實體瘤也發現了類似的效應,發生這種情況是因為來自供體(移植物)的白細胞攻擊高劑量化療后留在體內(腫瘤)的任何癌細胞。
但是也有不同意見,雖然在各種實體瘤中確實存在移植物抗癌效應,但是與血液系統惡性腫瘤相比,實體瘤中效應的機制和T細胞及其亞群與主要介質的相互作用可能有很大不同。也有學者認為,移植物抗腫瘤的效應通常發生在移植物抗宿主病之后,也有可能是移植物對于腫瘤微環境的改善,重新激活了宿主本身的免疫系統,起到效應器連接器的作用并非移植物本身。
盡管有不斷的案例報道,目前來說,移植物抗腫瘤效應作為治療方案特別是面對實體瘤的治療依然并非主流,但是在針對包括移植前體力狀態較好和化療反應性疾病的患者,依然可以從移植物效應中獲得最大益處。
從目前的的研究熱門CAR-T/NK來看,患者自體T細胞或者NK細胞改造后的移植實際上也是一種移植物抗腫瘤效應,只不過移植物的成分來自于自體避免了移植物抗宿主效應,腫瘤殺傷機制明確。而最新的異體臍血來源的NK細胞作為移植物載體成為新的熱點,一大原因也是其免疫原性低。
未來的移植物抗腫瘤研究方向需要精心設計的試驗來明確了解供體T細胞、NK細胞及其亞群的相互作用、GvT效應的機制,這些機制可能在實體瘤和血液系統惡性腫瘤中使用不同的機制,以優化此類治療的療效才能找到難治性實體瘤患者的治療方法。
參考文獻
1. Hayashi N, Kato Y, Miyakawa H, et al. Improvement of abnormal cervical cytology possibly due to a graft- versus- tumor effect: A case report and literature review. Clin Case Rep. 2021;9:e04835.
2. Eibl, B et al. “Evidence for a graft-versus-tumor effect in a patient treated with marrow ablative chemotherapy and allogeneic bone marrow transplantation for breast cancer.” Blood vol. 88,4 (1996): 1501-8.
3. Childs R, Chernoff A, Contentin N, et al. Regression of metastatic renal‐cell carcinoma after nonmyeloablative allogeneic peripheral‐blood stem‐cell transplantation. N Engl J Med. 2000;343(11):750‐758.
資料收集及翻譯審校: 西北農林科技大學生物國際班 趙一笑
下一條:干細胞給自身免疫性疾病帶來希望


