韓忠朝帶領的科研團隊發表《產業化開發是干細胞再生醫學服務大眾的關鍵》

醫學參考報是經中華人民共和國新聞出版總署批準、由國家衛健委主管的醫學專業報紙。
產業化開發是干細胞再生醫學服務大眾的關鍵
人類退行性疾病如心腦血管疾病、癌癥、糖尿病、老年癡呆等的患病率逐年上升。同時,世界上每天都有數以十萬計的嚴重腎臟衰竭病人、心臟衰竭病人正在生死線上掙扎,等待器官更換。然而,現行器官移植卻存在諸多問題:資源緊缺、器官移植造價昂貴、異體排斥等。
干細胞技術突飛猛進的發展,給人類健康帶來令人興奮的希望。修復、替代衰老損傷器官成為醫學界的重點研究領域,再生醫學技術成為治療許多傳統醫學難以解決的重大疾病的新希望。開發大量標準化的干細胞產品是推進再生醫學的發展和真正造福大眾的關鍵。
干細胞產品發展現狀及趨勢
干細胞產業鏈的發展涉及干細胞存儲、干細胞藥物開發、干細胞治療,未來以上三個方向發展空間巨大。
全球干細胞醫療市場規模已從2010年的215億美元,增至2015年的635億美元。預計到2018年,全球干細胞醫療市場將達到1,195億美元。國際知名咨詢公司Technavio發布了最新報告《全球細胞治療市場2017-2021》,報告指出,在2017年至2021年期間,全球細胞治療市場預計以23.27%的復合年增長率增長。
2015年我國干細胞相關產業規模達到300億元,并維持在50%上的高復合增長;預計到2021年,我國干細胞相關市場規模將接近1,500億元。
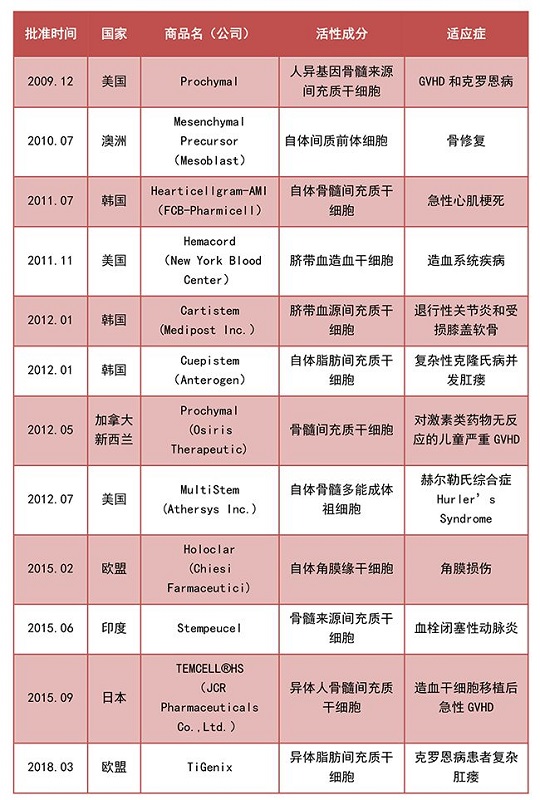
目前,全世界各國批準上市的干細胞產品有12種(多數為間充質干細胞產品),如下表:
我國對干細胞產品研發的支持政策
2017年10月26日,為貫徹落實中共中央辦公廳、國務院辦公廳《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》(廳字〔2017〕42號)和《國務院關于改革藥品醫療器械審評審批制度的意見》(國發〔2015〕44號),國家食品藥品監督管理總局(CFDA)組織對《藥品注冊管理辦法》進行了修訂,起草了《藥品注冊管理辦法(修訂稿)》,重申細胞治療類產品可以按藥物申報。2018年5月,習近平主席在北京大學考察時進一步指出,“加快干細胞轉化應用的步伐,盡快將干細胞成果應用于重大疾病治療當中,為健康中國的戰略做出貢獻”。近期,廣東、上海、河北、山東、云南、海南等地紛紛出臺政策,支持干細胞產業化。
國家政策支持干細胞行業發展的傾向愈加明朗,隨著干細胞科技的不斷發展,干細胞行業準入政策、監管政策不斷完善,預計在不久的將來,行業準入的干細胞適應癥范圍將繼續擴大,尚未準入的干細胞也將獲得準入許可,細胞治療的時代終會完全敞開大門。
我國的干細胞產業鏈的建設
干細胞產業鏈分為上、中、下游,產業鏈的全面發展是干細胞再生醫學真正服務大眾的關鍵。
1.干細胞產業鏈上游---干細胞庫。在中國,干細胞庫這一領域相對成熟。早在2004年,韓忠朝院士團隊就創建了臨床級臍帶和胎盤干細胞庫,申請了干細胞庫技術專利,在國際上發表了論文,并制定了首個間充質干細胞庫技術標準。目前,國家也制定了干細胞庫建立的系列標準,更進一步推動了干細胞庫的發展。只有建立標準的干細胞庫,才能為制備干細胞產品提供基礎。
2.干細胞產業鏈中游---干細胞產品的制備。在國外,應用于臨床的干細胞產品主要是骨髓來源的間充質干細胞。與國外不同,漢氏聯合團隊自主研發了臍帶和胎盤來源的間充質干細胞產品。與骨髓間充質干細胞技術相比,臍帶和胎盤間充質干細胞技術有不小的優勢:成本低、耗時短、治療效率高。胎盤和臍帶間充質干細胞來源豐富并且細胞增殖能力相對較強,產品制備耗時一個月就可以完成,而骨髓來源的間充質技術則需要三個月的時間。此外,由于臍帶和胎盤間充質干細胞獲得年齡為0歲,因此免疫原性更低,生物活性更好,只需要骨髓來源干細胞的1/2或1/3就可以達到很好的治療效果。
漢氏聯合已經開發出“臍帶間充質干細胞注射液”、“胎盤間充質干細胞注射液”和“干細胞凝膠制劑”等多個干細胞藥品(產品),這些制劑已完成臨床前安全性研究,且經中國食品藥品檢定研究院的產品核查,“臍帶間充質干細胞注射液”和“干細胞凝膠制劑”這兩款藥品,CFDA已正式受理1類新藥申報。
3.干細胞產業鏈下游---干細胞的臨床應用。漢氏聯合在國際上首次利用成人外周血造血干細胞治療下肢缺血性疾病取得成功,在國際上首次用胎盤間充質干細胞移植治療Ⅱ型糖尿病取得顯著療效。另外,漢氏聯合已發表多篇干細胞臨床應用論文,對移植物抗宿主病、難愈合創傷、自身免疫性疾病、冠心病等進行了干細胞治療,并顯示了療效。然而,在進行更廣泛的干細胞臨床應用前,還需要建立不同疾病狀態下所用干細胞的最佳種類、劑量、應用次數、效果評判標準等參數。
除以上干細胞產業鏈的發展,由此衍生出來的全球醫療旅游產業發展迅猛,世界旅游組織將其定義為“以醫療護理、疾病與健康、康復與休養為主題的旅游服務”,具有附加價值高且低污染的特點。
目前醫療旅游較為熱點的幾個國家分別為印度、泰國、韓國、美國、日本、新加坡以及瑞士等。國家對醫療旅游也非常重視,目前國內以政府主導的醫療旅游示范區主要有4個,分別是海南博鰲樂城國際醫療旅游先行區,江西上饒國際醫療旅游先行區,山東青島國際醫療旅游先行區及江蘇常州國際醫療旅游先行區。
展望
目前,國際上已批準的干細胞產品來自骨髓、脂肪和臍血,多數為自體干細胞制劑,系個體化治療產品。只有韓國批準的Cardistem、加拿大批準的Prochymal、印度批準的Stempeucel和歐盟批準的TiGenix為干細胞藥物,分別來自異體的骨髓和脂肪組織,但尚無圍產期組織(臍帶和胎盤)來源的干細胞藥物問世。
迄今為止,CFDA尚未批復任何一款干細胞新藥,在干細胞新藥方面明顯落后于發達國家。然而,我國在圍產期干細胞的基礎和臨床應用研究,以及干細胞藥物開放等方面,走在世界前列。通過對圍產期干細胞新藥及相關產品研發和產業化開發,有望獲批多個國家干細胞I類新藥。
干細胞新藥及全產業鏈的發展必將進一步促進干細胞在疾病治療、抗衰老及醫學美容方面的應用,促進大眾健康。
下一條:2018年中國干細胞行業政策匯總


