Cell:鄧宏魁與湯超等封面報道細胞重編程過程中的創新方法和理論
來源:生物360

近日,北京大學鄧宏魁研究組和湯超研究組合作,首次證明小鼠體細胞重編程可由調控分化的基因完成,并在此基礎上提出細胞命運轉變的“蹺蹺板模型”。2013 年5月23日,該成果研究論文“Induction of pluripotency in mouse somatic cells with lineage specifiers”于《細胞》(Cell)期刊以封面文章形式在線發表。《細胞》同期還配發了希伯來大學 Nissim Benvenisty 教授對于該工作的評論文章。
2006年,日本科學家 Shinya Yamanaka 發現向小鼠體細胞轉入胚胎干細胞特異因子(OCT4, SOX2, KLF4, c-MYC)可以完成體細胞的重編程。在此之后,細胞重編程領域普遍認為向目標細胞狀態的轉變需要靠在目標狀態中特異高表達的因子的誘導。因此目前發現的 能夠在細胞重編程中發揮作用的因子均在胚胎干細胞中高表達并且與細胞干性維持緊密相關。
傳統觀點認為分化因子與干性因子是相互拮抗,相互抑制的。干性基因在胚胎干細胞中高表達,抑制分化基因;分化基因在胚胎干細胞中不表達或低表達,高表達這些分化因子將抑制干性因子,破壞胚胎干細胞多能性的狀態,導致其分化。

然而鄧宏魁研究組通過大規模篩選發現,細胞重編程中至關重要的干性因子OCT4能夠被調控中內胚層(ME)發育和分化的因子(如 GATA3,GATA6,PAX1)代替;SOX2能夠被調控外胚層(ECT)發育和分化的因子(如GMNN)代替。進一步,湯超研究組根據這一發現創新 性地建立了“蹺蹺板模型”,來更好的理解中胚層基因和外胚層基因在重編過程中的相互抑制和相互平衡的關系,這種關系可能決定了細胞命運的維持和改變。這個 模型提供了誘導體細胞重編程的其它方法的預測,甚至還有一個出乎意料的模擬結果:如果同時過表達中內胚層和外胚層基因,就可以達到平衡從而同時替代 SOX2和OCT4。而我們的實驗結果也進一步證實了這個可能,首次實現了用ME分化因子和ECT分化因子同時替代掉了細胞重編程過程中最關鍵的兩個干性 因子OCT4和SOX2。這一發現改變了向目標細胞狀態的轉變需要用在目標細胞狀態中高表達的因子的誘導的這一傳統觀點,為研究細胞命運轉變提供了新視 角,重新認識了細胞重編程和細胞命運決定的機制。
鄧宏魁研究組博士生舒健、吳晨、吳業濤與湯超研究組博士生李志遠為共同第一作者,鄧宏魁研究組博士后趙揚也在這一工作中發揮了關鍵作用。鄧宏魁、湯超均為北大-清華生命科學聯合中心成員。

圖1.“Seesaw模型”的landscape圖
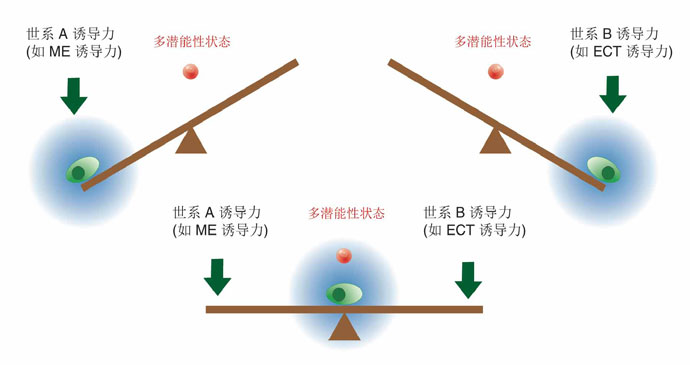
圖2. 細胞命運決定的“蹺蹺板模型”
原文檢索:
Jian Shu, Chen Wu, Yetao Wu, Zhiyuan Li, Sida Shao, Wenhui Zhao, Xing Tang, Huan Yang, Lijun Shen, Xiaohan Zuo, Weifeng Yang, Yan Shi, Xiaochun Chi, Hongquan Zhang, Ge Gao, Youmin Shu, Kehu Yuan, Weiwu He, Chao Tang, Yang Zhao, Hongkui Deng. Induction of Pluripotency in Mouse Somatic Cells with Lineage Specifiers. Cell, 23 May 2013; DOI: 10.1016/j.cell.2013.05.001


