漢氏聯合成果專欄25:探索干細胞外泌體的疾病治療作用
大家知道,干細胞具有神奇的再生功能,對許多難治性疾病具有良好的治療作用。
然而,大家可能不知道的是,干細胞分泌的活性物質也都是寶。例如,間充質干細胞分泌的細胞外囊泡和外泌體,都具有疾病治療作用。
外泌體是指包含了復雜RNA和蛋白質的小膜泡 (30-150nm),其中包含大量活性物質。
細胞外囊泡(EVs)是細胞主動釋放的納米級膜囊泡,主要包括外泌體和微泡。
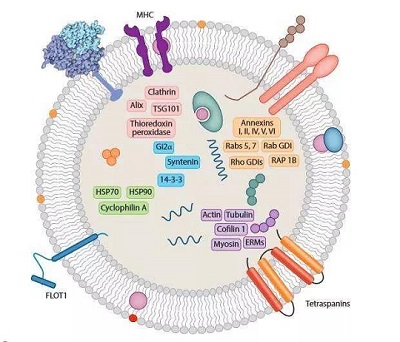
(圖|外泌體)
由于干細胞的制備、運輸、保存都需要很嚴苛的條件,而外泌體和細胞外囊泡的活性更穩定,也更容易保存。因此,外泌體和細胞外囊泡已經成為科學研究的熱點,也是干細胞衍生產品開發的新方向。
漢氏聯合研發團隊很早就意識到這一趨勢,在外泌體和細胞外囊泡的治療作用方面做了大量研究工作,并發表了系列國際論文。
為了便于大家了解到干細胞外泌體和細胞外囊泡領域的最新研究進展和未來的應用前景,在此將漢氏聯合研發團隊完成的相關成果作一介紹。
1、神奇的“一氧化氮”氣體增強干細胞外泌體的功能
論文題目:Enhanced proangiogenic potential of mesenchymal stem cell-derived exosomes stimulated by a nitric oxide releasing polymer(一氧化氮增強間充質干細胞外泌體的促血管生成能力)

有研究發現,間充質干細胞外泌體具有促進血管新生的功能。
那么,有沒有什么方式能夠更進一步增強外泌體的促血管新生功能,從而進一步提升對缺血性疾病的治療效果?
有,那就是神奇的氣體---一氧化氮。
在本研究中,漢氏聯合研發團隊設計了一種能夠自動釋放一氧化氮的多聚物。 將這一多聚物加入胎盤間充質干細胞的培養體系后,多聚物釋放的一氧化氮能夠刺激外泌體的釋放。這些被一氧化氮刺激后釋放的外泌體能夠顯著增強人臍靜脈內皮細胞的血管生成作用。此外,在小鼠后肢缺血模型中,經一氧化氮刺激釋放的外泌體顯示出更好的促血管生成作用,能夠明顯改善肢體功能。
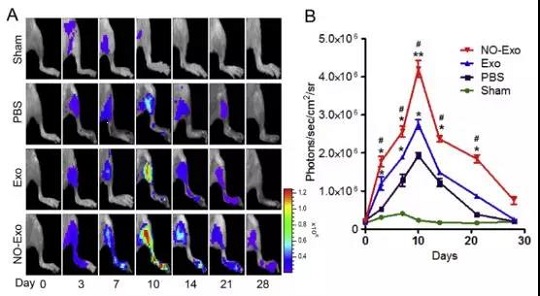
一氧化氮刺激釋放的外泌體對小鼠后肢缺血的治療作用更強大
進一步的分析表明,一氧化氮刺激后胎盤間充質干細胞釋放的外泌體中富含VEGF和miR-126,它們可能是導致外泌體促進血管生成能力增強的原因。
漢氏聯合研發團隊的這一研究表明,在胎盤間充質干細胞培養微環境中加入能夠釋放一氧化氮的多聚物,有助于開發促血管新生能力更強的外泌體,未來用于缺血性疾病的治療。
2、間充質干細胞外泌體能夠增強化療藥對白血病的治療效果
論文題目:Exosomes from mesenchymal stromal cells enhance imatinib-induced apoptosis in human leukemia cells via activation of caspase signaling pathway(間充質間質細胞外泌體通過激活caspase信號通路,增強伊馬替尼誘導白血病細胞凋亡的作用)

《我不是藥神》這部電影相信大家都看過,其中的一個治療白血病的神藥叫"格列衛",是治療慢性粒細胞白血病的靶向藥物。
大家也許不知道的是,格列衛的化學名叫伊馬替尼。它并沒有大家想的那么神,只對大約70%的慢性粒細胞白血病患者有效,耐藥性是其藥效減低的重要原因。
因此,伊馬替尼的耐藥性在慢性粒細胞白血病治療中是一個不得不面對的挑戰。
漢氏聯合研發團隊的研究發現,臍帶間充質干細胞外泌體本身對慢性粒細胞白血病細胞株K562細胞的存活和凋亡(凋亡,即程序性細胞死亡,"凋"取自樹葉凋零的隱喻)無明顯影響。然而,臍帶間充質干細胞外泌體能夠加強伊馬替尼對K562細胞的毒性作用,包括抑制活力和促進凋亡。
臍帶間充質干細胞外泌體的作用機制是增強了伊馬替尼誘導的Bax蛋白(一種促進細胞凋亡的信號蛋白)表達增加和Bcl-2蛋白(一種抑制細胞凋亡的信號蛋白)表達減少。另外,臍帶間充質干細胞外泌體聯合伊馬替尼可進一步激活K562細胞的細胞內激酶caspase-9和caspase-3,它們都是促進腫瘤細胞凋亡的信號蛋白。
這些結果表明,人臍帶間充質干細胞分泌的外泌體能夠降低K562細胞對伊馬替尼的耐藥性,增強其敏感性,進而有望改進治療效果。因此,伊馬替尼與臍帶間充質干細胞外泌體聯合應用有望成為提高慢性粒細胞白血病療效的一種有效途徑。
3、間充質干細胞外泌體與水凝膠結合,治療作用更強大
論文題目:Enhanced Therapeutic Effects of Mesenchymal Stem Cell-Derived Exosomes with an Injectable Hydrogel for Hindlimb Ischemia Treatment(可注射用水凝膠增強間充質干細胞外泌體對下肢缺血的治療作用)

雖然干細胞外泌體的疾病治療作用越來越受到重視,但是在臨床應用中,如何維持外泌體在體內的長期活性和穩定性,仍是一個重要的挑戰。
我們知道,物質通常在溫度高時傾向于變化為液態或氣態,在溫度低時傾向于變為固態。科學家開發了一種神奇的生物材料,特性與我們的常識正好相反:溫度低時為液態,在溫度逐漸升高時會轉變為固態。水凝膠就是這樣一種神奇的生物材料,它在4°C時為液體,在37°C時為固態。

水凝膠在4°C時為液體,在37°C時其中的分子就相互交聯為固態
漢氏聯合研發團隊利用水凝膠的這一獨特屬性,在4°C液態時與人胎盤間充質干細胞分泌的外泌體充分混合(外泌體水凝膠),然后注射入體內。由于身體溫度是37°C,外泌體水凝膠會變為固態,外泌體就可以被穩定在病變部位發揮治療作用。
漢氏聯合研發團隊的研究數據表明,除了發揮固定作用,提高靶向治療的效果,水凝膠可以增強外泌體的穩定性和活性,對血管內皮細胞具有保護作用,并能夠促進血管生成,增強小鼠下肢缺血的治療效果。
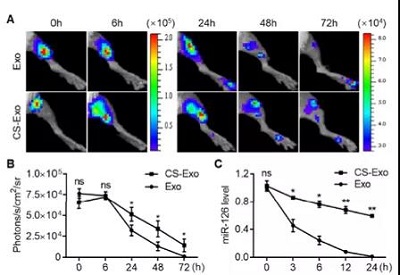
外泌體水凝膠對小鼠后肢缺血的治療作用更強大
漢氏聯合團隊利用水凝膠大大增強干細胞外泌體的治療效果,為未來干細胞衍生品的產業化開發提供了思路。
4、間充質干細胞分泌的細胞外囊泡能夠保護血管,預防血管栓塞和鈣化
論文題目:MSC-derived sEVs enhance patency and inhibit calcification of synthetic vascular grafts by immunomodulation in a rat model of hyperlipidemia(間充質干細胞來源的細胞外囊泡能夠抑制高血脂大鼠體內移植血管的鈣化)

由于患者體內病理環境的影響,移植入患者體內的血管容易發生鈣化而再次發生堵塞。間充質干細胞分泌的細胞外囊泡中包含大量活性分子,如微小RNA和細胞因子,具有改善血管功能的作用,有預防血管堵塞的潛能。
在本研究中,漢氏聯合研發團隊開發了一種經細胞外囊泡功能化處理的血管移植物,并在患有高脂血癥的大鼠體內進行了功能評價。 首先,研發團隊用肝素處理血管移植物,以增強其抗凝血能力。然后,將間充質干細胞分泌的細胞外囊泡加載到血管移植物上,獲得功能性血管移植物。
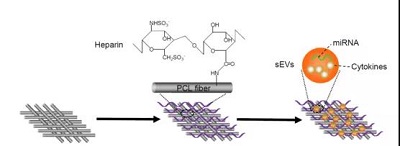
細胞外囊泡功能化處理血管移植物的過程
將血管移植物植入大鼠體內,替代一段大鼠腹腔內的一段動脈(約1?厘米長)。
結果表明,間充質干細胞分泌的細胞外囊泡能夠有效抑制血管內血栓形成和鈣化,提高血管移植物的通暢性。而且,研發人員還發現,細胞外囊泡內的生物活性分子,如血管內皮生長因子(VEGF)、miRNA126、miRNA145等,能夠顯著促進血管內皮細胞和血管平滑肌細胞的再生。更重要的是,間充質干細胞分泌的細胞外囊泡顯示出強大的免疫調節作用,能夠誘導巨噬細胞從促炎和導致動脈粥樣硬化的M1表型向抗炎和抗動脈硬化的M2表型轉變。
總之,研發團隊的結果表明,間充質干細胞分泌的細胞外囊泡能夠有效預防血管鈣化和栓塞,顯著提升血管性能,在心血管疾病治療中具有重要意義。
結語
以上成果主要由漢氏聯合干細胞研究院副院長,北京經濟技術開發區領軍人才,李宗金教授帶領研發團隊完成,代表了干細胞領域內的領先研究水平。
漢氏聯合研發團隊的目標是將所開發的外泌體和細胞外囊泡產品獲得藥監局的批準并上市,服務廣大患者。相信這一目標在不久的未來會變為現實。


